
期刊:Immunity
影响因子:26.3
主要技术:scRNA-seq、ST-seq、Total seq
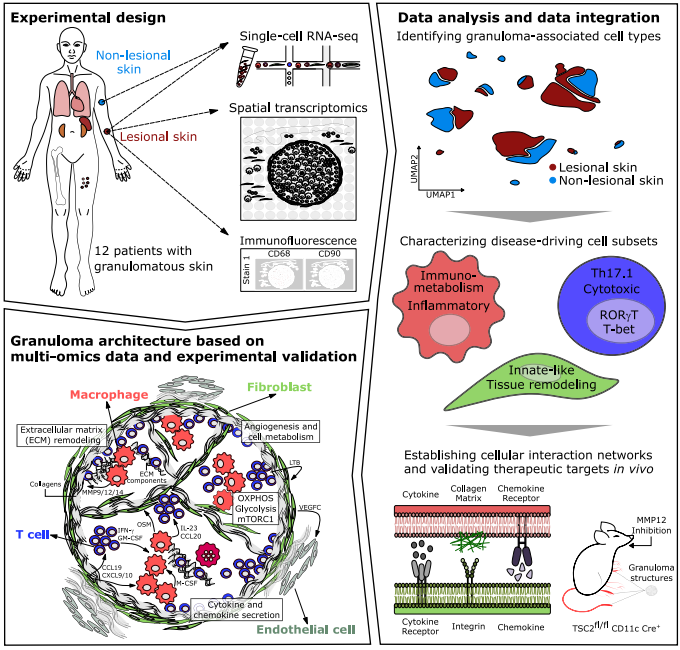
导语
肉芽肿是由免疫细胞形成的结节,可出现在多种器官中。其细胞组成复杂,包括巨噬细胞、多种T细胞及成纤维细胞等,巨噬细胞可融合成多核巨细胞,T细胞通过分泌干扰素-γ等因子驱动炎症,而成纤维细胞产生细胞外基质,常导致纤维化。大多数肉芽肿看似无结构,但与淋巴器官有某些相似之处。为了更好地理解肉芽肿的形成,本研究对12名结节病患者的肉芽肿及匹配的非病变皮肤样本进行了单细胞测序和空间转录组学研究。发现巨噬细胞呈现糖酵解和氧化磷酸化重编程,辅助T细胞获得慢性激活的Th17.1表型,成纤维细胞则分化为免疫招募和组织重塑两大亚群,三者通过CSF、IFN-γ、LTB及多种趋化因子和整合素-ECM相互作用,共同维持促炎微环境。跨器官验证显示关键基因和通路高度保守,靶向巨噬细胞弹性蛋白酶MMP12的小鼠实验证实可显著减轻肉芽肿。该研究为非感染性肉芽肿的精准治疗提供了新靶点和理论依据。
亮点
对结节病肉芽肿进行了单细胞测序和空间转录组学研究;
重建了肉芽肿及其基因调控网络的结构;
在肉芽肿中发现了一个由致病性巨噬细胞、T细胞和成纤维细胞组成的网络;
将淋巴器官发育的共享机制作为结节病的药物靶点进行测试;
关键技术
scRNA-seq、ST-seq、Total seq
实验结果
1. 巨噬细胞、T细胞和成纤维细胞是皮肤肉芽肿的主要细胞类型
为研究肉芽肿的细胞组成和基因调控,对12名皮肤结节病患者的病变和非病变皮肤活检样本进行了单细胞RNA测序(scRNA-seq)(Fig1A)。得到56000个细胞,通过注释得到淋巴细胞、髓系细胞、角质形成细胞等八种主要的细胞类型(Fig 1B),并发现病变皮肤与非病变皮肤相比存在广泛的转录变化(Fig 1C)。为绘制肉芽肿的组织背景,对所有12名患者的皮肤活检样本进行了空间转录组学和免疫荧光蛋白染色(Fig1A)。利用从scRNA-seq数据中获得的基因特征,将空间转录组学特征分解为病变和非病变皮肤区域(Fig1D)。免疫荧光识别出CD3+ T细胞、CD68+巨噬细胞和CD90+成纤维细胞是肉芽肿内的主要细胞类型(Fig1E),这证实并扩展了的scRNA-seq数据分析。
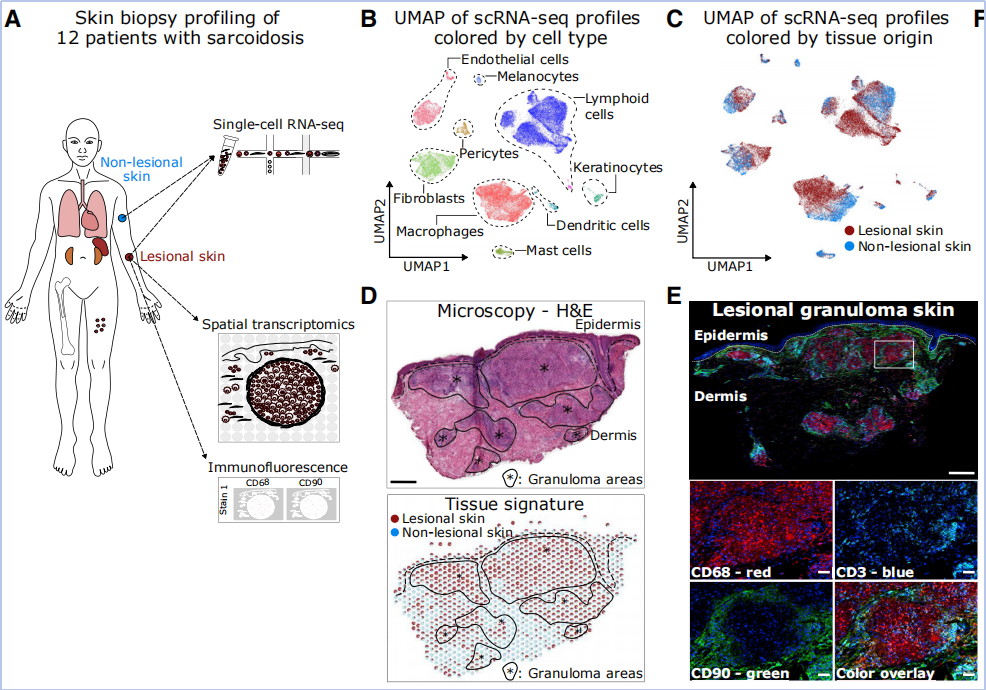
Fig 1
2. 特异性巨噬细胞、T细胞和成纤维细胞亚群在肉芽肿中聚集
根据转录相似性识别出20个细胞簇,并根据marker基因的表达进行标记,在病变和非病变皮肤中观察到7个非免疫细胞群和13个免疫细胞群(Fig 2A-B)。其中病变巨噬细胞、病变辅助T细胞和病变成纤维细胞几乎仅在病变皮肤中发现其(Fig 2C)。为评估细胞亚群的定位,对空间转录组学数据进行了分析,得到四个群(Fig 2D)。并从组织学角度将这些群注释为肉芽肿性真皮、未受影响的真皮和表皮;结合单细胞数据分析显示,病变亚群的巨噬细胞、辅助T细胞和成纤维细胞主要存在于肉芽肿性真皮群中,而非病变亚群则存在于未受影响的真皮群中(Fig2E-F)。将病变和非病变巨噬细胞、辅助T细胞和成纤维细胞的基因表达谱映射到所有样本的空间转录组学谱上,进一步证实了这一观察结果,病变基因集在肉芽肿内部表现出高活性,而非病变基因集主要在周围的真皮中表达(Fig2G)。

Fig 2
3. GA巨噬细胞显示出强烈的促炎信号
为研究皮肤肉芽肿中巨噬细胞的作用,对所有巨噬细胞进行了降维和无监督聚类分析,得出了两个主要亚群。cluster 0中的细胞与病变皮肤相关,而cluster 1群中的细胞主要来源于非病变皮肤;差异分析揭示cluster 0中髓系细胞的慢性激活转录谱,将cluster 0群相关的髓系细胞称为“肉芽肿相关(GA)巨噬细胞”,并将1群中的细胞称为“稳态巨噬细胞”(Fig 3A-B)。GA巨噬细胞高表达ACE、CHI3L1、CHIT1、CYP27A1、S100A8、IFNGR1及多种与IFN-γ激活、溶酶体功能、细胞外基质和代谢相关的基因,表现出一种非典型、促炎且代谢活跃的巨噬细胞表型(Fig3B)。为进一步表征GA巨噬细胞,重新聚类了所有巨噬细胞,并识别出两个病变亚群:GA巨噬细胞群GA0和GA1(Fig3C)。GA0巨噬细胞高表达与结节病相关的基因以及金属蛋白酶,而这些基因在GA1巨噬细胞中表达下调;同时,GA0巨噬细胞的基因特征被特异性定位到结节病肉芽肿区域,提示GA0巨噬细胞在肉芽肿形成和维持中发挥关键作用(Fig3D-F)。GA0巨噬细胞高表达编码巨噬细胞集落刺激因子(M-CSF)的CSF1基因,这是巨噬细胞生存、分化和增殖的关键因子,可以分泌M-CSF,从而增加局部组织炎症,并与CHIT1、CCL20、IL23A、MMP12和DCSTAMP等炎症相关基因的表达升高密切相关,提示GA0巨噬细胞具备促进炎症反应、细胞迁移和多核巨细胞形成的能力(Fig3G)。
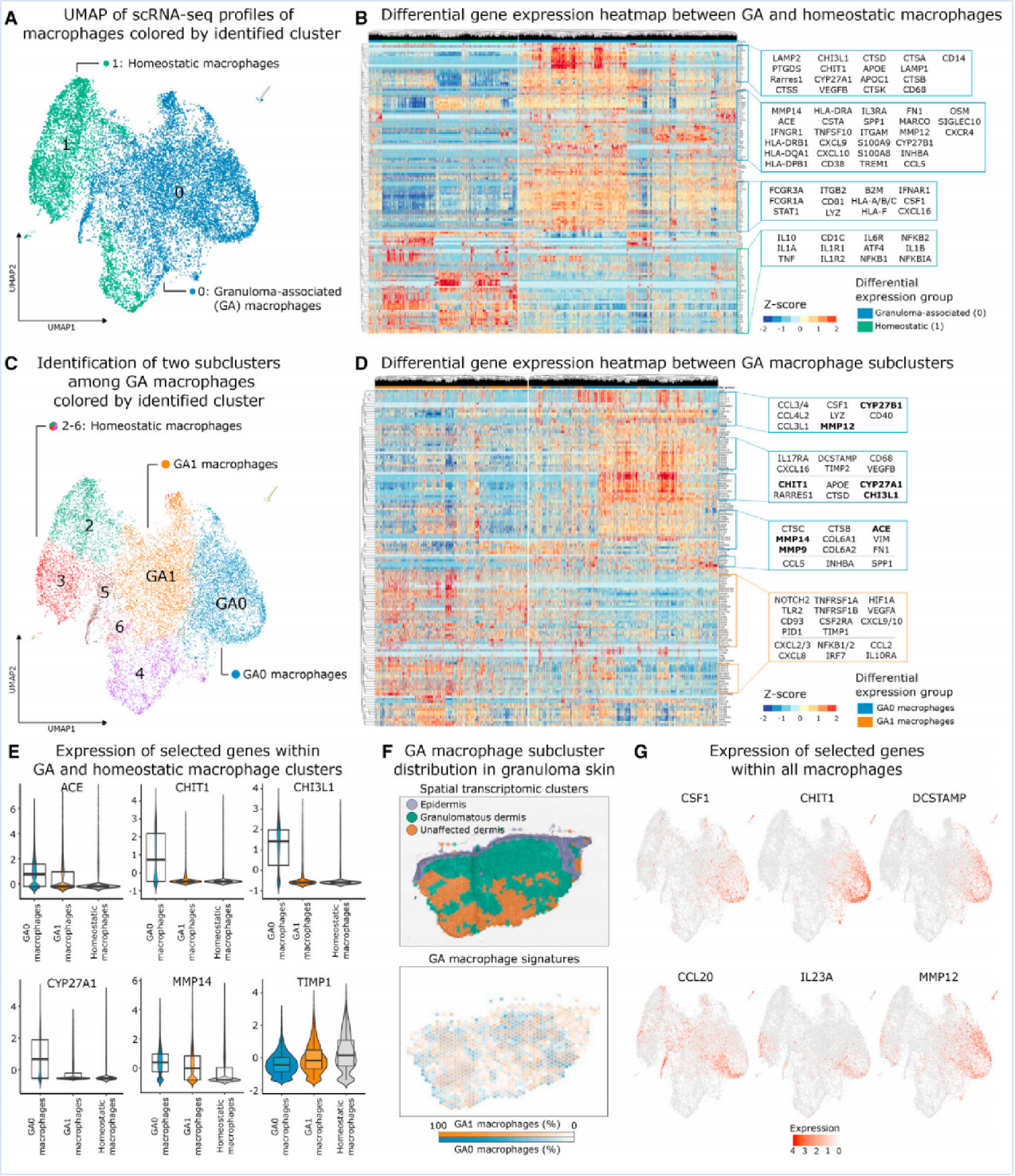 Fig 3
Fig 3
4. 具有Th17.1表型的T细胞在肉芽肿中富集
将淋巴细胞细分,识别出包括辅助性T细胞、调节性T细胞、细胞毒性CD8 T细胞和NK细胞等七种淋巴细胞;cluster 0的辅助性T细胞包括病变和非病变皮肤细胞,而cluster 1的细胞主要来自病变皮肤(Fig4A)。将cluster 0称为稳态辅助性T细胞,将cluster 1称为GA辅助性T细胞,构成了一个肉芽肿特异性的细胞亚群。GA辅助性T细胞表现出慢性激活的Th17.1表型,由IL-23和IL-12驱动,产生大量IFN-γ和GM-CSF激活髓系细胞(Fig4B),并共表达转录因子T-bet和RORγt(Fig4C-D)。此外,Th17.1细胞通过CCL20-CCR6轴被招募至炎症部位,其中CCL20由髓系细胞产生,而CCR6则表达在T细胞表面(Fig4B)。免疫荧光蛋白染色进一步证实,在肉芽肿内部定位的CD3+ T细胞上表达CCR6(Fig4E)。
 Fig 4
Fig 4
5. 结构细胞促进肉芽肿局部炎症和组织重塑
成纤维细胞识别出三个群,Cluster 0主要与非病变皮肤相关,称为“稳态成纤维细胞”,cluster1主要由病变皮肤组成,称为“GA成纤维细胞”,cluster2则包含来自两种来源的细胞混合(Fig5A)。GA成纤维细胞高表达促炎基因OSMR及慢性炎症相关标记FAP、PDPN和THY1,并表现出比稳态成纤维细胞更高的细胞异质性,主要由于其包含两个功能不同的亚群;“免疫相互作用成纤维细胞”高表达细胞招募、抗原呈递和TGF-β信号相关基因;“组织重塑成纤维细胞”则高表达细胞外基质(ECM)成分、基质调节和血管生成相关基因(Fig5B-C)。GA成纤维细胞在肉芽肿附近高表达促炎标记物FAP,其中免疫相互作用成纤维细胞位于肉芽肿周围,而组织重塑成纤维细胞主要位于肉芽肿内部,提示ECM成分在肉芽肿内被分泌(Fig5D)。为识别有助于肉芽肿形成的成纤维细胞中的转录调节因子,将GA成纤维细胞与稳态成纤维细胞进行了比较,GA成纤维细胞高表达免疫相关转录因子(如IRF8、RELB、STAT2等)以及发育和IFN反应相关转录因子(如HOXC6、IRF5等),这些转录因子有助于在皮肤肉芽肿中观察到的天然免疫样功能和炎症表型,提示成纤维细胞在肉芽肿形成中发挥免疫调节和组织重塑作用(Fig5D-E)。
 Fig 5
Fig 5
6. 提示其在肉芽肿形成中发挥免疫调节和组织重塑作用
为理解细胞类型在肉芽肿形成中的相互作用,基于配体-受体表达预测细胞间的相互作用分析细胞间的通信。在肉芽肿内,GA辅助性T细胞通过表达IFNG作用于巨噬细胞和结构细胞上的IFNGR1,同时表达LTB与巨噬细胞、成纤维细胞和内皮细胞上的LTBR结合,促进血管生成和ECM重塑(Fig6A)。空间转录组学数据进一步揭示了肉芽肿内部存在多种细胞间的配体-受体相互作用,包括趋化因子及其受体、细胞因子及其受体等,如内皮细胞表达的PECAM1(CD31)与肉芽肿内GA巨噬细胞和T细胞表达的CD38之间存在相互作用(Fig6B),免疫荧光蛋白染色证实(Fig6C)。此外,成纤维细胞、T细胞和内皮细胞表达多种整合素(如ITGA4、CD44),与ECM等成分(如FN1、SPP1)结合,介导免疫细胞的黏附和迁移(Fig6D)。免疫荧光蛋白染色验证了整合素与ECM成分(如SPP1-CD44和FN1-α4β1)之间的相互作用,进一步支持分子在肉芽肿内免疫细胞迁移和黏附中的作用(Fig6E)。
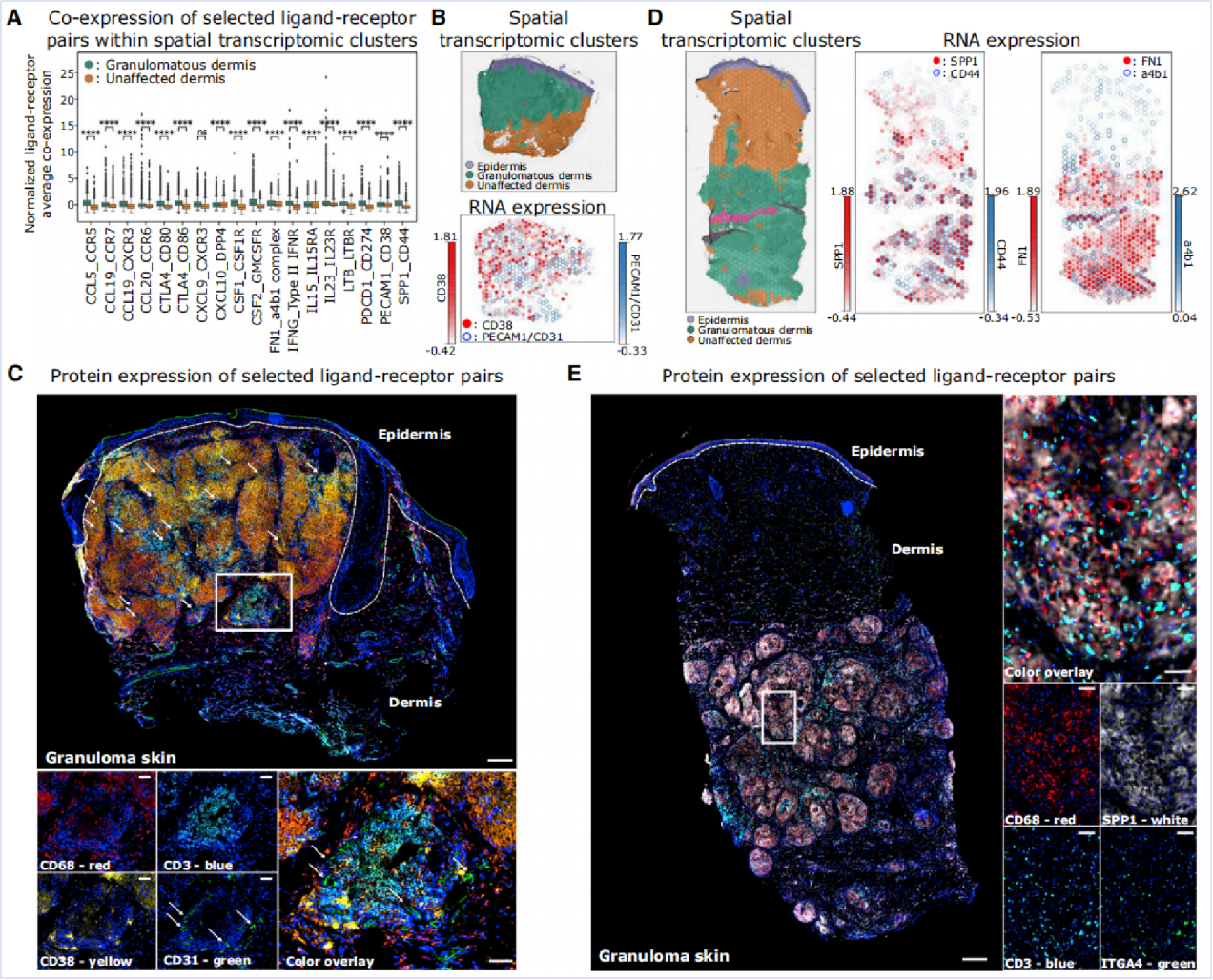
Fig 6
7. 肉芽肿与TLS具有共同的关键特征
本研究揭示了肉芽肿与三级淋巴结构(TLS)的相似性,TLS在非淋巴组织中形成,有助于有效的免疫反应(Fig7A)。通过研究一个包含12种趋化因子的TLS特征,发现这些趋化因子在肉芽肿中高度表达(Fig7B-C)。具体来说,CCL5、CXCL9和CXCL10在GA巨噬细胞中上调,CCL4和CCL5在GA T细胞中上调,而CCL5、CCL19、CXCL9、CXCL10以及CXCL11在GA成纤维细胞中上调(Fig7D)。此外,肉芽肿中CCL19-CCR7/CXCR3通路特异性激活,参与T细胞向淋巴器官的归巢(Fig7E)。通过使用另外两个TLS特征进行验证,发现肉芽肿与TLS之间高度相似。然而,肉芽肿中的辅助性T细胞促进巨噬细胞激活,而不是像在癌症中观察到的那样减弱炎症。因此,肉芽肿形成是一种失调和异常的淋巴器官形式,利用类似的调控机制,但未能重现生理正常TLSs的严格控制。最后,使用小鼠肉芽肿形成模型,通过药物FPA-014靶向基质金属蛋白酶MMP12,发现用MMP12抑制剂FPA-014治疗小鼠4周后,与对照治疗相比,肉芽肿诱导的四肢和尾部皮肤肿胀显著减少(Fig7F)。这些结果支持基质金属蛋白酶在肉芽肿形成和维持中的功能贡献,这可能是通过其作为细胞外基质调节剂和免疫细胞激活剂的作用介导的。
 Fig 7
Fig 7
结语
本研究整合单细胞转录组、空间转录组与免疫染色,系统绘制皮肤结节病肉芽肿的细胞-分子图谱,发现巨噬细胞通过糖酵解-氧化磷酸化重编程及mTOR信号上调、凋亡下调维持慢性炎症;辅助性T细胞呈现Th17.1表型,分泌IFN-γ、GM-CSF和LTB持续激活免疫;两类成纤维细胞中,免疫相互作用亚群充当“非造血免疫细胞”招募并保留免疫细胞,组织重塑亚群则与巨噬细胞协同驱动ECM重构。肉芽肿在趋化因子谱与空间组织上高度类似三级淋巴结构,却缺乏自限机制而成为慢性异常淋巴器官。跨器官验证显示关键调控基因共享,靶向MMP12的小鼠实验证实可抑制肉芽肿形成。综上,肉芽肿由免疫代谢重编程、细胞因子-趋化因子网络及ECM-整合素调控三轴驱动,为结节病等非感染性肉芽肿的精准干预提供了分子框架与候选靶点。
参考文献:
Krausgruber T, Redl A, Barreca D, et al. Single-cell and spatial transcriptomics reveal aberrant lymphoid developmental programs driving granuloma formation. Immunity. 2023 Feb 14;56(2):289-306.e7. doi: 10.1016/j.immuni.2023.01.014. Epub 2023 Feb 6. PMID: 36750099; PMCID: PMC9942876.
